L'atome et l'électron
L'atome
En tant que plus petite partie d'un corps, l'atome a été imaginé déjà dans l'Antiquité. Mais c'est seulement au 19 ème siècle qu'il put être étudier et modélisé. On doit à Ernest Rutherford, un physicien anglais d'avoir proposé la représentation de l'atome sous la forme d'un système solaire miniature. Alors que le nombre de molécules possibles nous parait infini, le nombre d'atomes est limité. Dans la nature on ne trouve pas plus de 92 corps simples différents. Alors qu'il est possible de fabriquer des molécules visibles avec un microscope électronique, l'atome a des dimensions qui sont de l'ordre de grandeur de l'angström.
Les corps simples les plus courants sont stables : un atome de cuivre restera éternellement un atome de cuivre. Par contre les atomes les plus lourds, comme le radium ou l'uranium, peuvent se désintégrer et donner naissance à un ou deux autres atomes. Ainsi le radium peut se transformer en radon, un gaz rare radioactif. Ces transformations sont exploitées dans le domaine de l'énergie nucléaire.
La structure de l'atome
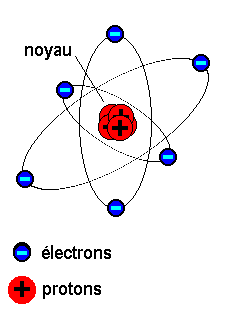
Conventionnellement on représente l'atome comme constitué d'électrons gravitant autour d'un noyau, comme le feraient des satellites autour d'une planète. Par rapport au diamètre de l'atome, le noyau semble très petit, la matière est essentiellement constituée de vide.
Le noyau est constitué de nucléons :
-
-
Z est le numéro atomique. L'oxygène qui comporte 8 protons a un numéro atomique 8.
Le nombre de masse A est égal à la somme Z+N, il est de 16 pour l'oxygène. Pour les noyaux lourds N est plus grand que Z (voir plus loin les isotopes) ; exemple le cuivre A = 63, N = 29, Z = 34.
La charge électrique du neutron est nulle. Le proton a une charge positive égale en valeur absolue à celle de l'électron qui lui, est négatif. A son état normal un atome est neutre, le nombre d'électrons étant égal au nombre de protons. Sur la figure ci-
L'essentiel de la masse de l'atome est concentré dans le noyau.
Voir :
Fractionner une goutte d'eau en deux parties aboutit à deux gouttes d'eau plus petites. Mais il arrive un moment où la plus fine goutte est constituée d'une seule molécule et couper cette molécule en deux fait que l'on se trouve en présence non pas d'eau, mais des constituants de la molécule d'eau : un atome d'oxygène et deux atomes d'hydrogène.
La molécule
La matière, qu'elle soit solide, liquide ou gazeuse se compose de molécules qui sont des groupements d'atomes. Par exemple le chlorure de sodium, le vulgaire sel de cuisine, est formé d'un atome de sodium et d'un atome de chlore. Le chlore et le sodium sont deux éléments simples, au même titre que l'hydrogène ou l'oxygène. Les molécules du gaz hydrogène sont formées de deux atomes d'hydrogène. Le symbole chimique de l'hydrogène en tant que gaz est H2, le chiffre 2 indiquant la présence de deux atomes H. Les associations d'atomes pour former des molécules sont soumises à des lois très strictes, imposées par la structure même des atomes mais il existe une quantité énorme de possibilités d'associations.
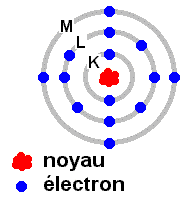
Les électrons, de charge négative, sont répartis par couches. Chaque couche ne peut comporter qu'un nombre limité d'électrons. Par exemple la couche K qui est la plus proche du noyau est saturée avec 2 électrons. La couche la plus à l'extérieur de la plupart des atomes n'est pas complète, elle peut ainsi accepter (provisoirement) des électrons, ou éventuellement en perdre. C'est le cas lors de l'ionisation d'un atome. Les gaz rares (hélium, néon, krypton...) ont la couche la plus extérieure qui est saturée, ils sont inertes sur le plan chimique.
Le nombre d'électrons maximum par couche est le suivant :
K : 2, L : 8, M : 18, N : 32, O : 50...
La figure ci-